研究内容
世界的にも独自の「骨の中の生きたままでのイメージング系」を駆使した研究展開
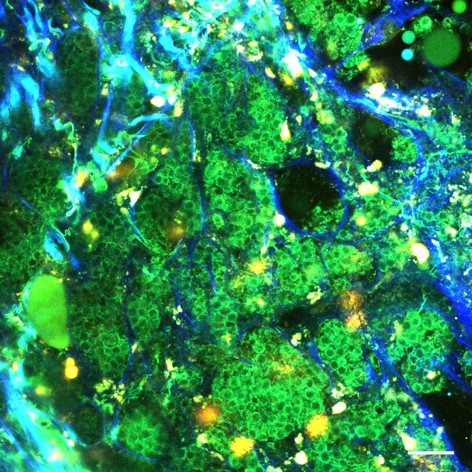
骨は極めて硬い組織で光をほとんど透過させないので、生きたままの状態で内部を観察することは不可能であると考えられてきました。これまでの骨の研究では、骨を取り出して、固いナイフで薄く切って組織標本にして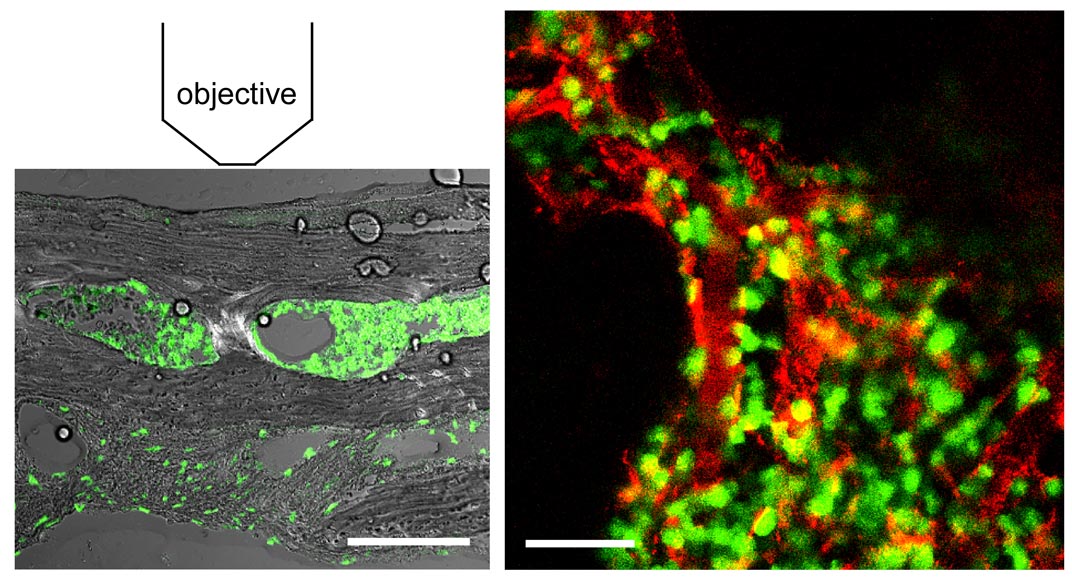 観察していました。当然ですが、このようにして解析すると、細胞の形は残っていますが、すでに死んでいるので動きません。当教室では、2光子励起顕微鏡という特殊な光学顕微鏡をうまく利用することにより、骨の内部・骨髄腔を生きたままの状態で観察すること(=骨髄腔内の「非破壊検査」ですね)に世界に先駆けて成功しました(Nature 2009; Nature Protoc 2009など)。これによって、今まで謎めいていた骨髄の中の生命現象が、手に取るようにリアルに分かってきました。
観察していました。当然ですが、このようにして解析すると、細胞の形は残っていますが、すでに死んでいるので動きません。当教室では、2光子励起顕微鏡という特殊な光学顕微鏡をうまく利用することにより、骨の内部・骨髄腔を生きたままの状態で観察すること(=骨髄腔内の「非破壊検査」ですね)に世界に先駆けて成功しました(Nature 2009; Nature Protoc 2009など)。これによって、今まで謎めいていた骨髄の中の生命現象が、手に取るようにリアルに分かってきました。
破骨細胞の動態と機能
破骨細胞は、骨を溶かすことで体内の血中カルシウム濃度を一定に保つ役割や、骨の新陳代謝を担う非常に重要な細胞です。しかし炎症や関節リウマチなどの自己免疫疾患では、異常に骨を破壊してしまい、私たちの生活を支える大切な骨を蝕むことがあります。また高齢なると多くの人が骨粗しょう症になりますが、この病態においても破骨細胞の異常な活性化がみられます。このように非常に大切な役割をもつ破骨細胞ですが、異常に骨を溶かしすぎないようにうまくコントロールする必要があります。私たちの研究室では、独自に開発した破骨細胞が光るレポーターマウスや、骨吸収領域が光るプローブを用いて、破骨細胞やその機能を可視化し、関節リウマチや骨粗鬆症などの病態解明や創薬開発を行っています。
1. 破骨前駆細胞の骨への遊走メカニズムの解明
破骨細胞は元々血液中のマクロファージ系由来の細胞で、これが骨表面に到達して「骨を食べるのに特化したマクロファージ」となったものです。骨髄内を生きたままでイメージングできるようになったことで、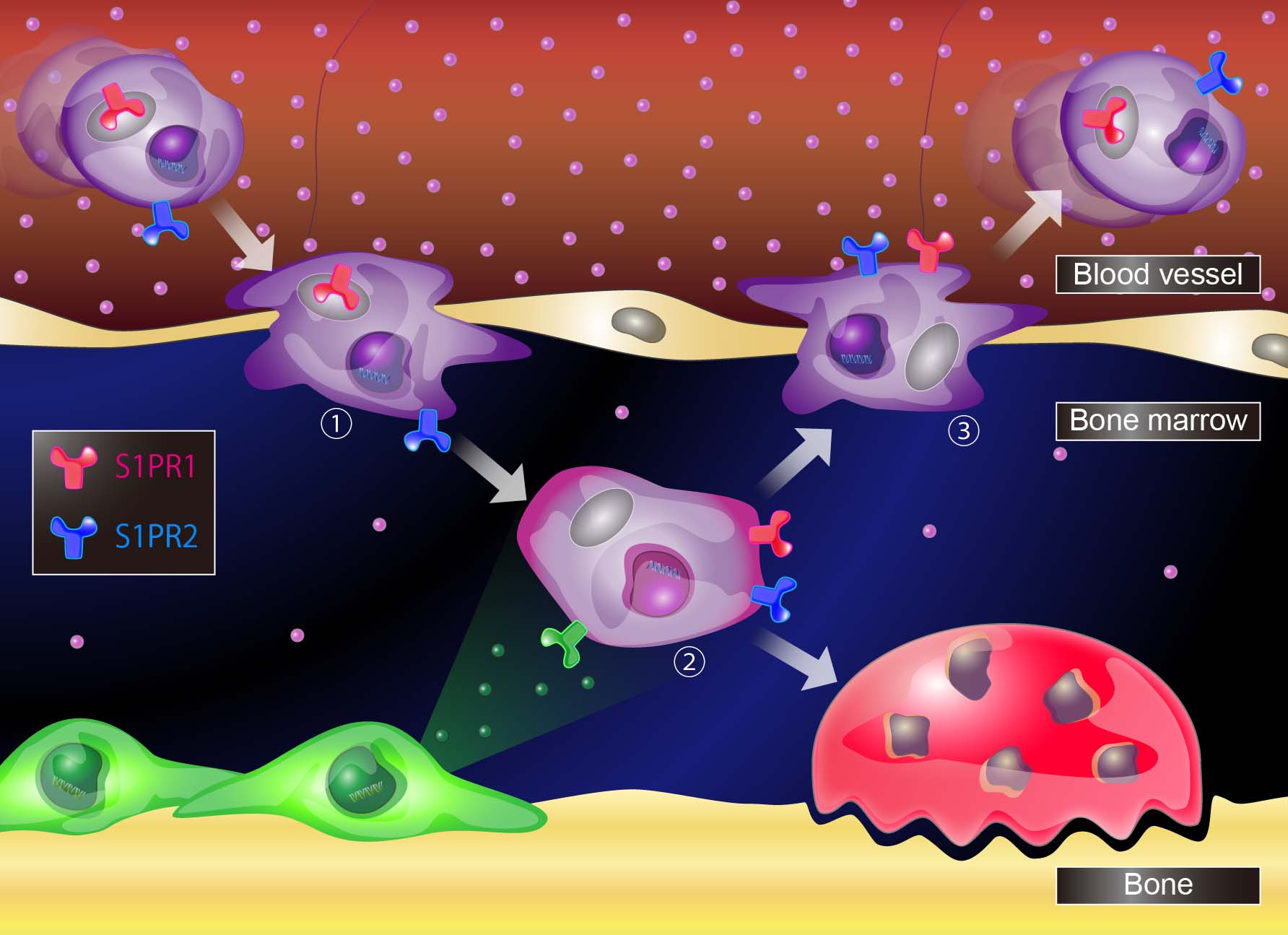 「マクロファージが骨に到達するメカニズム」を実体的に解析することができました。具体的には、破骨細胞になるマクロファージの骨の中での動きは、生理活性脂質の1つであるスフィンゴシン1リン酸(S1P)という物質によって巧妙に調節されていることを発見しました (Nature 2009; J Exp Med 2010; J Clin Invest 2012 ; J Immunol 2013 など)。さらに、昔から骨を強くすることが知られていましたが、そのメカニズムがよく分かっていなかったビタミンDが、S1Pによる破骨細胞の動きを調節することによって骨破壊を抑制することを発見しました(PNAS 2013)。
「マクロファージが骨に到達するメカニズム」を実体的に解析することができました。具体的には、破骨細胞になるマクロファージの骨の中での動きは、生理活性脂質の1つであるスフィンゴシン1リン酸(S1P)という物質によって巧妙に調節されていることを発見しました (Nature 2009; J Exp Med 2010; J Clin Invest 2012 ; J Immunol 2013 など)。さらに、昔から骨を強くすることが知られていましたが、そのメカニズムがよく分かっていなかったビタミンDが、S1Pによる破骨細胞の動きを調節することによって骨破壊を抑制することを発見しました(PNAS 2013)。
2. pH応答性蛍光プローブを用いた破骨細胞の機能の可視化
私たちは破骨細胞の主な機能である骨を溶かす機能を可視化する 「pH応答性蛍光プローブ」を大阪大学工学部 菊地和也教授との共同研究により開発し(J Am Chem Soc 2011)、破骨細胞が実際に骨を壊す様子を世界で初めて捉えました。このプローブを用いた骨髄の生体イメージングにより、破骨細胞には、活発に骨を溶かす「吸収期」の細胞と、骨を溶かしていない「休止期」の細胞が存在することを発見しました(J Clin Invest 2013)。さらに、骨粗鬆症モデルマウスでは骨表面の破骨細胞数が増加するだけでなく、そのほとんどが骨吸収期の破骨細胞であること、骨粗鬆症治療薬を投与すると、破骨細胞数が減少するだけでなく、ほとんどの細胞が「休止期」の状態に変化することを明らかにしました(JBMR 2018)。
「pH応答性蛍光プローブ」を大阪大学工学部 菊地和也教授との共同研究により開発し(J Am Chem Soc 2011)、破骨細胞が実際に骨を壊す様子を世界で初めて捉えました。このプローブを用いた骨髄の生体イメージングにより、破骨細胞には、活発に骨を溶かす「吸収期」の細胞と、骨を溶かしていない「休止期」の細胞が存在することを発見しました(J Clin Invest 2013)。さらに、骨粗鬆症モデルマウスでは骨表面の破骨細胞数が増加するだけでなく、そのほとんどが骨吸収期の破骨細胞であること、骨粗鬆症治療薬を投与すると、破骨細胞数が減少するだけでなく、ほとんどの細胞が「休止期」の状態に変化することを明らかにしました(JBMR 2018)。
3. 治療標的細胞(AtoM)の発見
これまで破骨細胞は1つの細胞の中で働きを変えることで、「良い働き」や「悪い働き」を行うと考えられてきました。しかし私たちは、炎症が起きている関節組織に病的に骨を破壊する「悪玉破骨細胞」へと変化する特殊なマクロファージが存在することを突き詰め、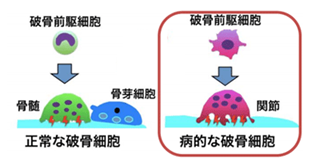 これを”arthritis-associated osteoclastogenic macrophage; AtoM”と命名しました。さらに、AtoMができる時に必要な分子を抑制することで、AtoMやそこから生じる「悪玉破骨細胞」が特異的に阻害され、骨の破壊を強力に抑えることを証明しました(Nat. Immunol. 2019)。現在、関節リウマチ患者の病的な「悪玉破骨細胞」を標的とした新たな治療薬開発へ向けて研究に取り組んでいます。
これを”arthritis-associated osteoclastogenic macrophage; AtoM”と命名しました。さらに、AtoMができる時に必要な分子を抑制することで、AtoMやそこから生じる「悪玉破骨細胞」が特異的に阻害され、骨の破壊を強力に抑えることを証明しました(Nat. Immunol. 2019)。現在、関節リウマチ患者の病的な「悪玉破骨細胞」を標的とした新たな治療薬開発へ向けて研究に取り組んでいます。
骨芽細胞の動態
骨芽細胞は、骨代謝において「骨を作る」という重要な役割を果たしています。骨を溶かす破骨細胞とバランスを保ちながら骨代謝をコントロールしています。私たちは骨芽細胞が骨を作る様子を生体イメージングで観察し、骨芽細胞が小胞を放出したり取り込んだりしていることを発見しました。骨芽細胞は骨表面で集団を形成して存在しており、この小胞を介して互いに連携し、骨代謝を制御していることがわかりました(Nat Commun 2022)。現在はこの骨芽細胞由来小胞のさらなる機能を解析し、創薬への応用へ向けて取り組んでいます。


破骨細胞と骨芽細胞の相互作用
骨組織は絶えず代謝をくり返すダイナミックな臓器です。私たちの研究室では、生体イメージングを通して、骨代謝をリアルタイムに可視化してきました。骨髄イメージングにより、破骨細胞と骨芽細胞はそれぞれ小集団を形成し、区域を分けて存在していることがわかり、両者の境界部では、破骨細胞と骨芽細胞が直接接触する様子が観察されました。さらに、骨芽細胞と接触している破骨細胞では、骨芽細胞と接触していない破骨細胞と比較して骨を溶かす機能が低下していることが明らかとなりました(Nat Commun 2018)。
さらに、PTH製剤による骨代謝制御メカニズムの解明にも破骨細胞と骨芽細胞の相互作用が重要であることが明らかとなってきました。副甲状腺ホルモン(PTH)は副甲状腺から分泌され、骨吸収を促進することで血液中のカルシウム濃度を増加させるように働きます。しかし投与方法によっては骨量を増加させることが示され、現在ヒト副甲状腺ホルモン1-34(テリパラチド)が骨粗鬆症治療薬として用いられています。PTH製剤が生体内で骨量を増加させる仕組みは解明されていませんでした。私たちはPTHを間欠的に投与した際に、骨芽細胞と破骨細胞の接触による細胞間相互作用が有意に増加し、破骨細胞の骨吸収能が抑制されていることを発見しました(Nat Commun 2018)。さらにその分子メカニズムとして、セリンプロテアーゼ阻害作用をもつ低分子タンパク質SLPIが骨芽細胞に直接的に作用して骨形成を促進しているほか、骨芽細胞と破骨細胞の細胞間相互作用を増加することで骨吸収と骨形成の両面を制御していることを明らかにしました(Nat Commun 2021)。

骨の中は様々な免疫細胞・血液細胞が誕生し、分化して機能する場であります。また、転移性のがん細胞の隠れ場所でもあります。骨の中を生きたままで解析することで、免疫学・血液学のみならず様々な生命科学の分野において今後も様々な研究成果が期待されます。
免疫細胞は広い体の中でどうやって動いていくの?働いているのか?
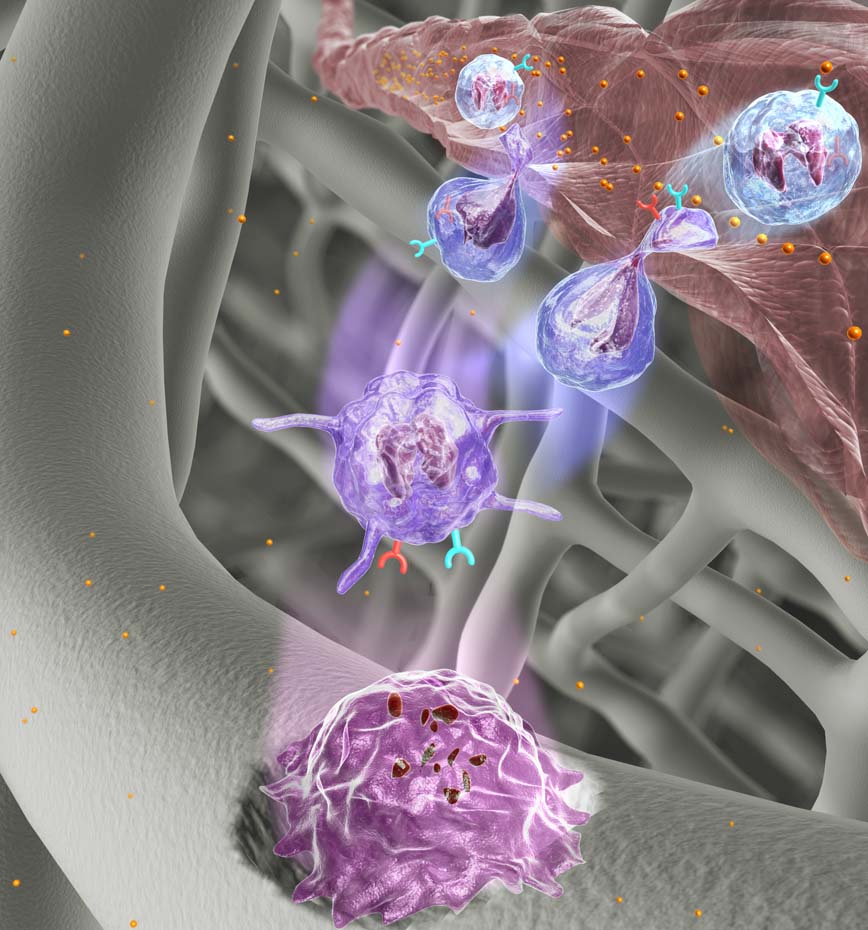 異物の侵入に対抗してそれらを排除しようとする体の応答です。免疫系では、自然免疫を担い全身をくまなくパトロールするマクロファージなどの細胞と、適応免疫を担うT細胞やB細胞が、組織内の適切な微小環境で会合し、互いに情報を交換することにより、正常な機能が維持されています。このような細胞動態は時空間的にとても精緻にコントロールされており、各細胞が適切な場所に適切な時間に存在しなければ、十分な機能を発揮することができません。これらの高度に統率された細胞動態ネットワークの解析には、生体多光子励起イメージングが大きく役立ちます。私たちの研究室では、マクロファージとリンパ球が情報交換をする「リンパ節」や「脾臓」、外界との最前線である「皮膚」「消化管」「肺」、代謝の中心である「肝臓」のイメージングに挑戦し、定常状態での恒常性の維持や炎症刺激に対する反応として、免疫細胞がどのような動態を示すかを解析しています。まさにSeeing is believingであり、見ることにより思いもよらないような発見が期待されます。
異物の侵入に対抗してそれらを排除しようとする体の応答です。免疫系では、自然免疫を担い全身をくまなくパトロールするマクロファージなどの細胞と、適応免疫を担うT細胞やB細胞が、組織内の適切な微小環境で会合し、互いに情報を交換することにより、正常な機能が維持されています。このような細胞動態は時空間的にとても精緻にコントロールされており、各細胞が適切な場所に適切な時間に存在しなければ、十分な機能を発揮することができません。これらの高度に統率された細胞動態ネットワークの解析には、生体多光子励起イメージングが大きく役立ちます。私たちの研究室では、マクロファージとリンパ球が情報交換をする「リンパ節」や「脾臓」、外界との最前線である「皮膚」「消化管」「肺」、代謝の中心である「肝臓」のイメージングに挑戦し、定常状態での恒常性の維持や炎症刺激に対する反応として、免疫細胞がどのような動態を示すかを解析しています。まさにSeeing is believingであり、見ることにより思いもよらないような発見が期待されます。
近年、マクロファージは抗原提示のみならず、多様な役割を果たすことが明らかとなり、様々な機能を持つ新たなサブセットの発見が続いています。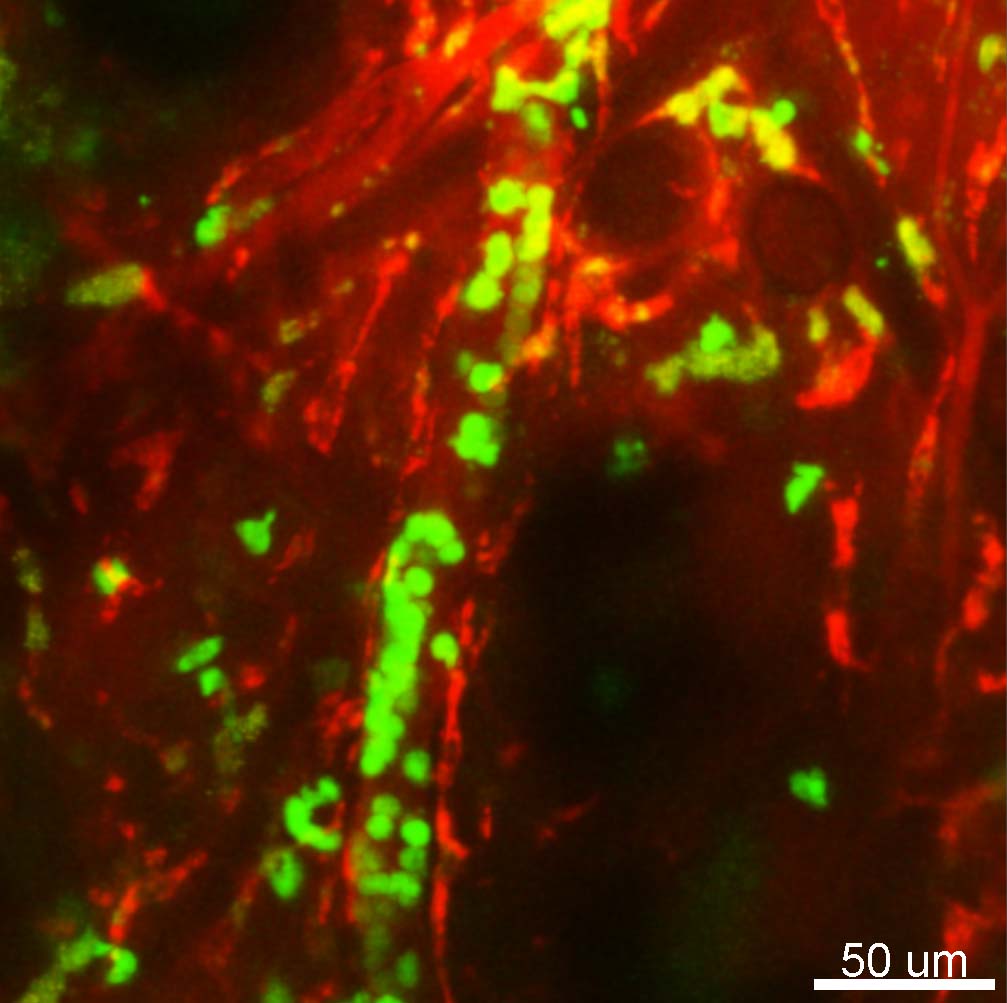 私たちの研究室では、生体多光子励起イメージング技術により、マクロファージが抗原提示をする現場や、皮膚や肺・腸をマクロファージがパトロールする様子をマウスが生きたままの状態で観察する中で、恒常性維持や病態形成に関わる新たな機能を持つマクロファージを発見してきました。これらのイメージング技術に加えて、FACSや1細胞遺伝子発現解析などのさまざまな方法論を組み合わせることで、マクロファージをはじめとした免疫・炎症細胞とその活動の場である微小環境を形成する上皮・間葉系細胞とが織りなす、細胞の社会活動を制御する基本原理を解明すべく、研究に取り組んでいます。
私たちの研究室では、生体多光子励起イメージング技術により、マクロファージが抗原提示をする現場や、皮膚や肺・腸をマクロファージがパトロールする様子をマウスが生きたままの状態で観察する中で、恒常性維持や病態形成に関わる新たな機能を持つマクロファージを発見してきました。これらのイメージング技術に加えて、FACSや1細胞遺伝子発現解析などのさまざまな方法論を組み合わせることで、マクロファージをはじめとした免疫・炎症細胞とその活動の場である微小環境を形成する上皮・間葉系細胞とが織りなす、細胞の社会活動を制御する基本原理を解明すべく、研究に取り組んでいます。
「イメージング研究」の次なる目標
技術革新,数理システム化
最近、イメージング研究は大きなブームとなっています。これまで見えなかったものを見るというのはそれだけでも大きな価値のあることです。特に、生きたままの体の中を見ることは、「ミクロの決死圏(私の世代よりもずっと前の古い映画)」の世界のような楽しさがあります。しかしながら、私達研究者としては、いつまでも「見えるものをただ見ている」だけでは進歩がありません。イメージングが進歩しても、まだまだ見えないものがたくさんあります。そこで当研究室ではイメージング技術を改良することにより、いまはまだ見ることができない現象を、見えるようにしたいと考えています。例えば、現在の生体イメージング技術では、生きた細胞の「動き」を見るのみですが、細胞は必要なところに動いて行って、そこで特殊な機能をもった細胞へと「分化・成熟」します。この過程は、かならずしも細胞の動きを伴わないことがあるので、イメージングをすることが難しいのですが、当研究室はちょっとした「仕掛け」を使って、細胞の分化・成熟を生体内で可視化することに挑戦しています。さらに、イメージングデータの解析手法や解析理論の確立にも積極的に取り組んでいます。イメージング研究とはまさにSeeing is believingの世界であると紹介しましたが、単に見るだけではサイエンスとして成立しないことも大きな事実です。見た現象を定量的に解析し統計的な有意差を示して初めてサイエンティフィックな議論の礎となるのです。そのために定量解析はとても重要ですが、イメージングデータは膨大な情報を含んだビックデータといえます。このような膨大なデータは、人が眺めているだけではその情報量に溺れてしまい「見えているはずなのに見えていない」「見えているはずなのに認識できていない」という状況に陥ってしまいます。当研究室では情報科学や数理統計解析の研究者の力を借りてこういった状況を打破しようとしています。イメージングデータと遺伝子発現解析など異なる解析結果を統合的に解析することも求められており、今後ますますイメージング研究に情報科学の知識やプログラミングといったスキルが求められるようになります。
ヒトへの応用
研究室では将来的には蛍光生体イメージング技術を「ヒトの臨床現場」 に持ち込んで、様々な病気の病態を解明する新たな診断方法や、新しい創薬のツールとして発展させたいと考えています。蛍光イメージングの分野では、2008年に緑色蛍光タンパク質GFPの発見でノーベル化学賞、2009年にはCCDカメラの発明でノーベル物理学賞、2014年に超高解像度蛍光顕微鏡の開発でノーベル化学賞を受賞しています。蛍光イメージングを用いた画期的な医療機器,疾患診断・治療法が開発されたら、ノーベル医学生理学賞の対象となるのも夢ではないかもしれません。
に持ち込んで、様々な病気の病態を解明する新たな診断方法や、新しい創薬のツールとして発展させたいと考えています。蛍光イメージングの分野では、2008年に緑色蛍光タンパク質GFPの発見でノーベル化学賞、2009年にはCCDカメラの発明でノーベル物理学賞、2014年に超高解像度蛍光顕微鏡の開発でノーベル化学賞を受賞しています。蛍光イメージングを用いた画期的な医療機器,疾患診断・治療法が開発されたら、ノーベル医学生理学賞の対象となるのも夢ではないかもしれません。
切らずにその場でがんをすぐ診断"光生検"の開発
がんの最終診断には、病気が疑われる部位から組織片を切り取って(=いわゆる「生検」や「手術」)、ガラス標本を作製し、病理医が顕微鏡で観察・診断する“病理診断”が不可欠です。しかしこの方法は、採取する組織片の量によって、診断の精度が左右されます。採取量が少ないと診断が確定できないことがある一方で、採取量を多くすると患者さんへの負担(=「侵襲」といいます)が大きくなり、稀ではあるものの合併症を生じうることが課題です。また、採取した組織片からガラス標本を作製するまでに、ホルマリン固定や染色など多くの処理工程が必要なため、患者さんが検査を受けてから診断できるまでに、時間がかかることも課題となっています。生体イメージングを用いると、体を傷つけずにその場で、広範囲に生体内を観察することができるようになります。またAIを駆使し、自動で病変部を検出・診断することで、医師の診断を強力に補助することが可能になります。私たちはこれまで、大腸がん、子宮頸がん、乳がんにおいて、“光生検”を用いたがんの診断技術を開発してきました(Sci Rep 2017; Cancer Res 2020; Cancer Sci. 2022)。現在はこれらの診断技術の医療機器への応用に取り組んでいます。
参考書籍(当教室が中心になってまとめた出版物)
・実験医学2011年10月号「生きたままの姿を見る4Dイメージング」
生体イメージング研究に関する(2011年当時の)トレンドを分かりやすく解説!
・実験医学別冊「In vivoイメージング実験プロトコール」
・Methods in Molecular Biology "Intravital Imaging of Dynamic Bone and Immune Systems"
蛍光イメージングを駆使した生体観察の原理・実際について、秘伝のプロトコールも含めて一挙公開。研究手法の「出し惜しみ」はキラいです。すべてをオープンにした上で、その上で正々堂々と勝負していきたいものです。